Moderna|新冠疫苗三期试验抢跑 Moderna或成全球赛首位撞线者
_原题为 新冠疫苗三期试验抢跑 Moderna或成全球赛首位撞线者
在新冠疫苗研发赛道中 , mRNA疫苗绝对是资本市场的“宠儿” 。
文章图片
图源:视觉中国
7月17日 , 抗疫概念股复星医药A+H早盘均高开高走 , 双双涨超6% 。 截至下午收盘 , 报40.1元 , 涨幅4.02% 。
而在前一日 , 复星医药宣布 , 控股子公司复星医药产业收到国家药监局关于其获许可的新型冠状病毒mRNA疫苗(BNT162b1)用于预防新型冠状病毒肺炎的临床试验批准 。
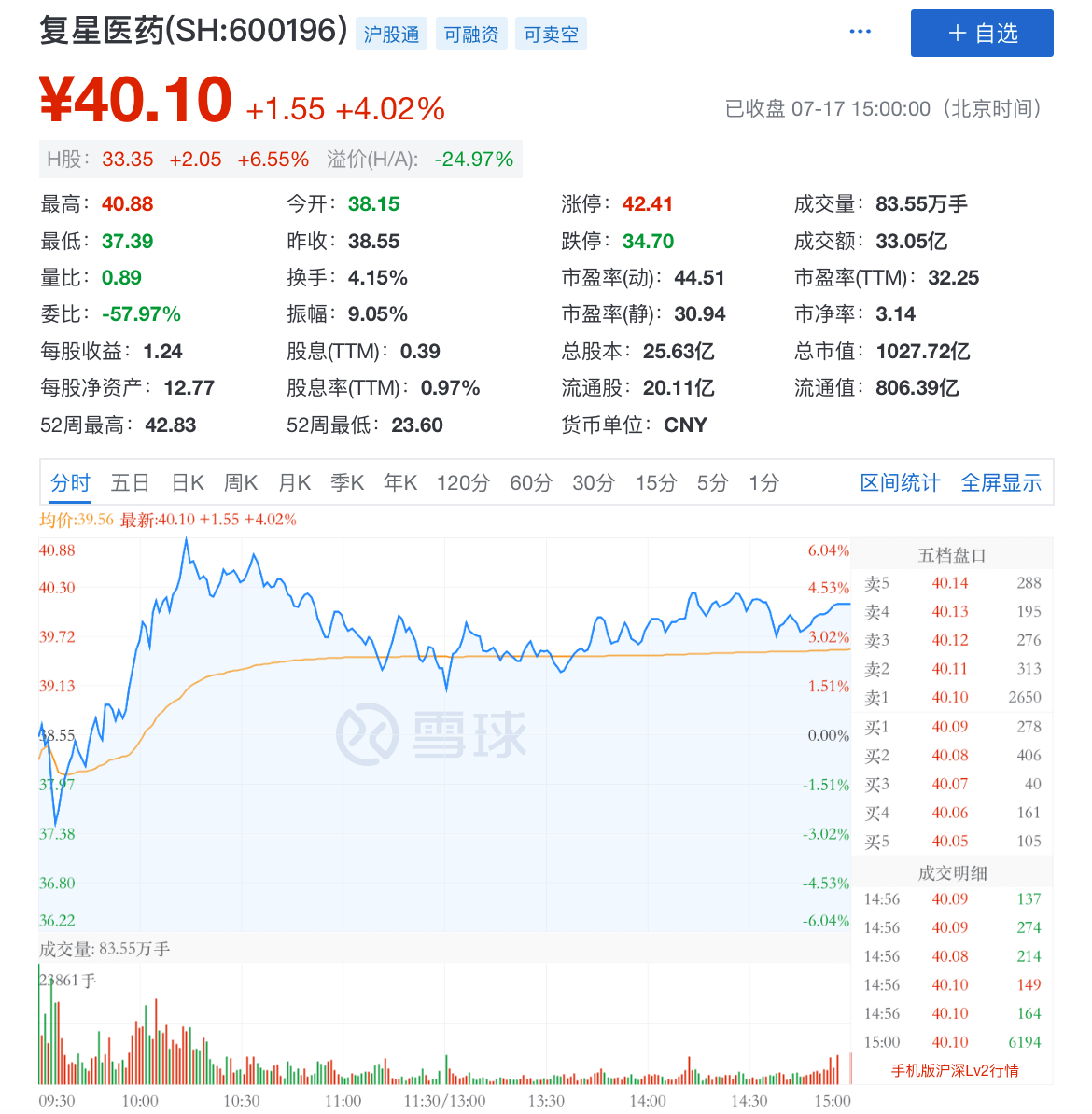
文章图片
图源:雪球
7月15日 , 美国生物医药公司Moderna(NASDAQ:MRNA)(以下称“Moderna”)在公布新冠疫苗mRNA-1273第一阶段临床试验的利好消息后 , 股价一度大涨22% , 并以一己之力拉升了当天美股市场的整体走势 。
据最新消息 , Moderna将于7月27日启动III期随机双盲对照临床试验 , 该试验将在全美87个地区进行 , 招募3万名志愿者 。
医药行业分析师、深圳中金华创基金管理有限公司董事长龚涛7月6日接受时代财经采访时表示 , 直接跳过动物实验、快速获批临床等特权让Moderna自带光环 。
同日 , 前上海疾控中心资深疫苗专家陶黎纳对时代财经表示 , “如果该疫苗能被最终证实有效 , 很可能成为全球第一款上市的mRNA疫苗 。 ”
疫苗有效性尚不得而知
今年3月中旬 , 时代财经从复星医药相关负责人处了解到 , mRNA疫苗(BNT162b1)是德国BioNTech SE授权开发的疫苗产品 。 (点击查看时代财经相关内容)
mRNA是一种携带遗传信息的核酸分子 。 mRNA疫苗将遗传信息导入体内 , 使得体内细胞产生相应抗原 , 从而诱导人体产生中和抗体并刺激T细胞应答 , 通过体液免疫及细胞免疫的双重机制对抗病毒 。 面对突发的重大疫情 , 和传统疫苗相比 , mRNA疫苗合成和生产工艺相对便捷 , 具有强大的免疫原性 , 不需要传统疫苗必需的附加佐剂 , 安全性更高 。
截至目前 , 复星医药mRNA疫苗已分别在德国、美国进行I期临床试验 。
不过 , 该疫苗尚处于临床试验初期 , 其关注度远不如即将进入最终临床的mRNA-1273 。
mRNA-1273是全球首个进入临床试验的新冠疫苗 , 自今年3月16日跳过动物实验 , 进入一期临床开始 , 就备受市场关注 , Moderna“身价”也一路水涨船高 。 3月以来 , 公司股价上涨203% , 市值涨至近320亿美元 。
陶黎纳对时代财经表示 , mRNA疫苗如果成功上市 , 它较低的生产成本会颠覆传统疫苗 , 引发疫苗领域的最大变革 。
此次mRNA-1273疫苗I期临床完整数据发布在《新英格兰医学杂志》 。I期临床试验评估了25微克、100微克与250微克三种疫苗剂量 , 采取了间隔28天的两针方案 , 并汇报了试验57天的结果 。
试验数据显示 , 疫苗在所有45名参与者体内均产生了“强大”的免疫反应 , 也印证了该公司此前于5月18日公布的“积极”的试验结果 。
不过 , 45名患者的样本量相对较小 , 试验数据虽然初步证明了疫苗的安全性 , 但疫苗能否有效阻止患者感染新冠病毒还缺乏有力的数据 。
时代财经注意到 , 超过一半的低剂量(25微克)受试者、全部的中剂量(100微克)受试者和高剂量(250微克)受试者产生了疲劳、头痛、寒颤、肌痛等副作用反应 。
Moderna公司称 , 这些副作用大都是短暂的 , 程度上均属于轻度或中度副作用 , 不需要进行额外评估 。
事实上 , 在全球新冠疫苗研究路线中 , 进入临床试验的灭活疫苗、腺病毒疫苗等均出现了相似的不良反应 。
海外医疗服务机构盛诺一家高级医学顾问庄时利和7月16日对时代财经表示 , “相比灭活疫苗、腺病毒疫苗等技术路线 , mRNA通过蛋白与自身免疫系统产生作用的原理 , 理论上会更加安全 。 ”
不过 , 由于目前并没有一款成功上市的mRNA疫苗 , 这项技术的有效性是否能通过临床考验还不得而知 。
3万人试验规模远超常规
目前 , Moderna正在进行mRNA-1273第二阶段的研究 , 最关键的III期临床试验将在本月27日开展 。
据了解 , III期临床试验将覆盖全美87个地区 , 招募3万名志愿者 。 目前 , Moderna已与生物医药研发外包公司Lonza合作 , 计划建设年产量5-10亿剂的疫苗生产线 , 有望在2021年初完成疫苗投产 。
值得一提的是 , 通常疫苗III期临床试验的受试者设定在1000-3000人 , Moderna计划招募的人数远远超过了常规试验规模 。
龚涛认为 , 3万受试者的规模或与新冠肺炎就医成本有直接关系 。 “美国近50%的人口没有购买医疗保险 , 新冠肺炎的治疗费用本高昂 , 很多新冠患者不具备就医能力 。 在此情况下 , 患者只能通过报名参加疫苗试验去争取免费治疗的机会 。 ”
不过 , 龚涛对于疫苗试验规模无限制扩大并不认可 。 他认为美国FDA医药研发的规则很有可能被打破 , 对整个医疗体系以及资本市场都会带来较大影响 。分页标题
同样开展大规模临床试验的还有另一家美国医药巨头 。
由美国辉瑞和德国BioNTech公司联合开发的两款新冠病毒mRNA疫苗 , 也预计将在本月底开展全球性、大规模的IIB/III期临床试验 , 受试者预估将多达3万人 。
该公司的两款新冠病毒mRNA疫苗在试验初期就获得了美国食品药品监督管理局(FDA)“快速通道”(Fast Track)批准认定 。
凭借与Moderna相同的技术路线和强大的企业背书 , 辉瑞正在新冠病毒“疫苗竞赛”中逐步赶上 , 与Moderna的竞技也会越来越激烈 。
全球在研新冠疫苗超160种
临床试验的大规模展开以及各国在政策上表现出的“宽容”姿态 , 正是基于全球疫情的严峻现实 。 截至北京时间7月17日14:10 , 全球累计确诊愈1380.86万例 , 死亡逾58.99万例;美国累计确诊357.62万例 , 单日新增超7.73万 。
除Moderna、辉瑞、复星医药等企业之外 , 国内也有数个在研的mRNA新冠疫苗项目 。 6月19日 , 军事科学院军事医学研究院与云南沃森生物技术股份有限公司、苏州艾博生物科技有限公司联合研发的mRNA疫苗获批进入临床试验 , 成为中国首个获批临床的核酸疫苗 。 此外 , 冠昊生物、西藏药业等公司的mRNA疫苗也处于临床前准备阶段 。
据世界卫生组织(WHO)最新统计数据 , 全球各大制药企业研发的新冠疫苗已超过160种 。其中 , 中美英三个国家的疫苗项目均已进入了临床试验阶段 。
在2020年上半年 , 包括国药集团、康希诺等至少6个中国团队的新冠疫苗进入临床试验阶段 。 美国则有三家 , 分别是Moderna公司的mRNA疫苗、辉瑞公司的mRNA疫苗、INOVIO公司的DNA载体疫苗 。
值得一提的是 , 在Moderna公布一期临床试验数据不久前 。 英国牛津团队的新冠腺病毒疫苗的人体试验结果提前曝光 , 并将于7月20日在《柳叶刀》上公布一期实验结果 。
据报道 , 第一期人体试验显示 , 接种疫苗的志愿者不但产生了抗体 , 而且还产生了可杀死病毒的T细胞 , 即牛津疫苗可提供“双重防护”(double defence) 。 如进展顺利 , 研究人员希望该疫苗最早可以在十月准备就绪 。
除此之外 , 全球多个企业近期披露了较为乐观的早期数据 。
BioNTech、国药生物、武汉生物、科兴生物、康希诺均对其疫苗I/II期临床数据进行了完整或初步揭盲 。 结果显示 , BioNTech、国药生物、武汉生物疫苗在接种21天后 , 中和抗体阳转率分别达100%、100%、97.6% 。 科兴生物接种14天后中和抗体阳转率达90% 。 康希诺未披露具体数据 , 但称II期临床试验数据证实疫苗具有良好的安全性 , 及较高的体液免疫及细胞免疫应答水平 。
【Moderna|新冠疫苗三期试验抢跑 Moderna或成全球赛首位撞线者】本网站上的内容(包括但不限于文字、图片及音视频) , 除转载外 , 均为时代在线版权所有 , 未经书面协议授权 , 禁止转载、链接、转贴或以其他 方式使用 。 违反上述声明者 , 本网将追究其相关法律责任 。 如其他媒体、网站或个人转载使用 , 请联系本网站丁先生:chiding@time-weekly.com
- 新冠|确诊!广东男篮小外援为新冠肺炎无症状感染者
- 人民日报客户端|最新:全球新冠肺炎确诊超1450万例 美国超377万例
- 刚取27连胜创CBA纪录,广东宏远就官宣外援马尚新冠检测阳性
- CBA广东宏远篮球俱乐部:外援马尚·布鲁克斯新冠检测呈阳性
- 广东男篮外援马尚·布鲁克斯新冠检测呈阳性
- 美国|疫情下的美国:穷人的不易与富人的不义
- 新冠|印度单日新增病例超4万例
- 央视网|持续三位数新增,?澳大利亚维多利亚州单日新增275例新冠肺炎确诊病例
- |央视宣布救世主出现?中国疫苗已领先世界半年
- 广东男篮官方确认外援马尚新冠检测阳性!目前在东莞接受隔离治疗
